熱容量、比熱容量
熱容量とは、「物質の温度を単位温度上昇させるために必要な熱量」を言います。
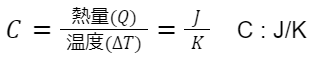
定圧モル熱容量・・・定圧過程における1モル当たりの熱容量のこと
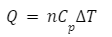
Q:熱量、n:モル数、Cp:定圧モル熱容量、ΔT:温度変化
定積モル熱容量・・・定積過程における1モル当たりの熱容量のこと
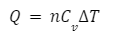
Q:熱量、n:モル数、Cv:定積モル熱容量、ΔT:温度変化
比熱容量とは、「物質の温度を単位温度辺り、単位重さ辺り上げるのに必要な熱量」を言います。
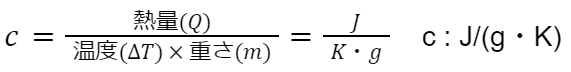
熱容量と比熱容量の関係は C=cm です。
上記から熱量を求める式は下記になります。
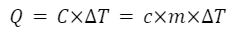
マイヤーの関係式
熱容量は定圧変化、定積変化によって異なります。それぞれCp と Cv で表され、理想気体の場合、Cp と Cv は次の関係があります。 (Rは気体定数)
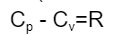
定圧熱容量と定容熱容量の比(γ)を「比熱容量の比」と言い、下記で表されます。
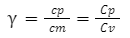
また、単原子分子、多原子分子では比熱容量γは次の通りです。
単原子分子 ![]()
2原子分子 ![]()
エントロピー
エントロピーとは「温度Tが一定の状態で熱量Qを受けたときの変化」を言います。このことからエントロピーは下記の式で定義されています。
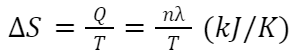
ΔS:エントロピー変化[kJ/K]、Q:熱量[kJ]、T:温度[K]
n:物質量[mol]、λ:単位物質量当たりの熱量[kJ/mol]
カルノーサイクル
熱力学第二法則の通り、熱は高温から低温へ移動します。ある物体を冷凍機によって冷やす場合、冷凍機はある物体の熱によって、温められます。つまり、熱は行ったり来たりして、変化をしています。ある物質が最初の状態から状態変化によって熱の移動を経て、最初の状態に戻ることをサイクルと言います。
カルノーサイクルにおける熱効率
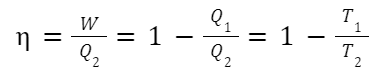
η:熱効率、W:仕事、Q2:高温側の熱量、Q1:低温側の熱量
T2:高温側の温度、T1:低温側の温度
液体の変化
液体の体膨張係数
一般に、液体の温度が上昇すると液体の体積が増えます。
体膨張係数とは、温度上昇とともに変化する体積の変化について表したものです。
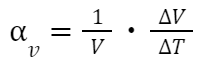
液体の圧縮率
圧縮率とは、液体に圧力をかけた際の体積変化について表したものです。
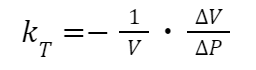



コメント