高圧ガス乙種機械の学識試験では、近年、問4で理想気体の状態変化に関しての試験問題が出題されています。理想気体の状態とくると状態方程式を思い浮かべる受験者の方も多いと思います。理想気体の状態方程式を用いた問題は問2で出題されることが近年は、多くなっています。問4では、気体の性質や熱との関係に関する内容を問う問題が多く出題されます。計算問題だけではなく、気体についての知識を問う問題が主に出題されますので、しっかりと暗記するようにしてください。
理想気体の状態方程式とは
PV=nRT
P:圧力(Pressure)(Pa)、V:体積(Volume)(m3)、n:モル数(mol)、
R:アボガドロ定数 8.314(J⋅K−1⋅mol−1)
この式を用いた問題が出題されない時はないといっても過言ではありません。そのため、必ず、覚えるようにしてください。
理想気体の状態方程式を用いた問題で密度を求める問題が出題されることがあります。
密度ρ(ロー)とは単位体積あたりの質量を言い、理想気体の状態方程式を変形して求めることができます。![]()
Boyle law(ボイルの法則)
『温度一定条件における気体の体積は、圧力に反比例する。』
![]()
P:圧力(Pressure)(Pa)、V:体積(Volume)(m3)、c:一定
上式を数学的に見るとP = c/Vとなり、反比例しています。
ある物資の圧力、または体積を変化させた際のどうなるのかといった問題が出題されます。
Charles law(シャルルの法則)
『圧力一定条件における気体の体積は、温度に比例する。』
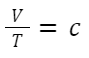
V:体積(Volume)(m3)、T:温度(Temperature)(K)、c:一定
※この際の温度Tはセルシウス温度ではなく、絶対温度で数値を代入してください。
※T(K) = t (°C) + 273 (K)
上式を数学的に見るとT = cVとなり、比例しています。
こちらも条件を変化させた際、温度もしくは体積がどのように変化したのかといった問題が出題されます。
Boyle-Charles law(ボイル・シャルルの法則)
ボイルの法則、シャルルの法則をまとめて
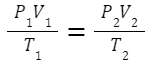
として必ず覚えてください。
ボイルの法則、シャルルの法則はそれぞれ別々で
ボイル・シャルルの法則を用いた問題は、式に当てはめることで解答できる問題が多く、得点源にしやすい分野です。
Dalton law(law of partial pressure,ドルトンの分圧の法則)
『混合気体の全圧は、成分気体の分圧の総和に等しい』
そもそも全圧とは、2種類以上の気体が混ざりあっているとき、混合気体の圧力のことを言います。
また、その際の各物質単独での気体が同体積ある場合の各圧力のことを言います。
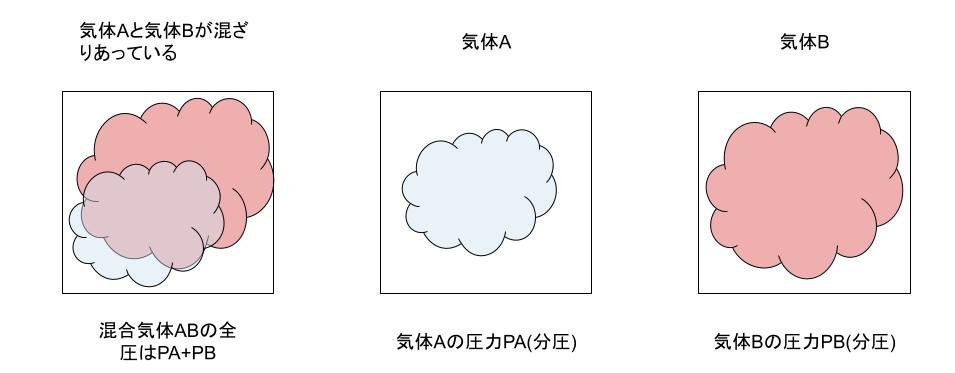
混合気体の組成と分圧の関係
分圧の比 = 物質量の比が成り立ちます。
Pa:Pb = na:nb
また、上記から「Aの分圧 = 全圧 × Aのモル分率」が導かれます。
定積変化、定圧変化、等温変化、断熱変化
理想気体がする仕事、熱量、内部エネルギー変化はそれぞれ、W、Q、Uで表されます。
W:仕事、Q:熱量、U:内部エネルギー
それらは、温度T、圧力p、体積Vによって変化するため、下記の条件によって変化することが知られています。
定積変化
密閉された瓶の中に、水素を入れます。この瓶を温めるとどうなるでしょうか。水素分子は激しく運動します。しかしながら、瓶はペットボトルと異なり、膨らんだりしないため、仕事W=0です。そのため、定積変化では、Q = Uとなります。
定圧変化
圧力を一定にして、変化させた場合、どうなるでしょうか。圧力は一定なだけで、圧力がないわけではありません。そのため、熱を与えた場合、内部エネルギーも増加し、仕事もします。つまり、定圧変化では、Q = U + W となります。
等温変化
温度一定における変化では、内部エネルギーUが変化しないため、U=0です。よって、等温変化では、Q = Wとなります。また、等温圧縮では、熱量は仕事に等しいと言えます。
断熱変化
では、密閉されたぺちゃんこのペットボトルの中にある水素に熱を与えない状況ではどうでしょうか。ぺちゃんこのペットボトルがいきなり膨らみだした場合、熱は与えられていないわけですから、内部エネルギ-が仕事ということになります。つまり、断熱変化では、0 = U + Wとなります。



コメント