気体と液体の性質の過去問傾向
気体と液体の性質については、乙種機械の学識において近年、毎年出題される分野です。2012年からの過去の12年分から出題傾向をまとめました。気体と液体の性質は2017年から出題傾向が変わっています。2017年以降では、理想気体の状態方程式やドルトンの分圧の法則を用いた計算問題が1問出題されています。2016年までは、計算問題はほとんどなく、4択の選択問題であり、計算問題の出題はかなり少ないです。まずは、理想気体の状態方程式、ドルトンの分圧法則をしっかりと理解し、出題傾向が変わっても対応できるようにその他についても学習すると良いと思います。
| 項目 | 出題数 |
| 理想気体の状態方程式 | 7 |
| ドルトンの分圧法則 | 6 |
| 比熱容量 | 2 |
| 実在気体 | 2 |
| 飽和蒸気圧 | 2 |
| ボイル・シャルルの法則 | 2 |
| その他 | 3 |
練習問題
ここでは、理想気体の状態変化分野における基本的な用語や知識に関する問題を掲載しています。問1~6は過去に複数回出題された内容に関する内容です。
次の各問について、適切な語句や意味を答えなさい。
P:Pressure(圧力)、V:Volume(体積)、n:物質量、R:気体定数8.314[J/(mol・K)] = 8.314×103[Pa・L/(mol・K)]、T:Temparature(温度)
1m3 = 1000L、1MPa=1.0×106Pa、1kMPa=1.0×103Pa、T(K)=t(°C)+273(K)
上記は問題文には記載されていません。しかしながら、問題を回答するにあたって必要な知識ですので必ず覚えてください。
問1.3Lの容器の中に、22gの理想気体Aが圧力2.0MPa、温度27℃で存在する。理想気体Aの分子量を求めなさい。
P=2.0×106、V=3.0、T=300(K)とし、物質量n=物質の量m/分子量Mなので、n=22/Mとすると
理想気体の状態方程式にPV=nRTに代入して
2.0 × 106 × 3.0 = 22/M × 8.314×103 × 300
⇄ M = 22 × 8.314×103 × 300 ÷ 2.0×106 ÷ 3.0
⇄ M = 9.145 (g/mol)
解答:9.15 g/mol
問2.27℃、3.0MPaで3Lを占める酸素の物質量を求めよ。
P=3.0×106、V=3.0、T=300(K)、物質量nを理想気体の状態方程式にPV=nRTに代入して
3.0 × 106 × 3.0 = n × 8.314×103 × 300
⇄ n = 3.0×106 × 3.0 ÷ 8.314×103 ÷ 300
⇄ n = 3.6083 (mol)
解答:3.6 mol
問3.圧力2.0MPa、温度77℃、物質量4.5molの理想気体が占める体積はいくらか求めなさい。
P=2.0×106、T=350(K)、n=4.5を理想気体の状態方程式にPV=nRTに代入して
2.0 × 106 × V = 4.5 × 8.314×103 × 300
⇄ V = 4.5 × 8.314×103 × 300 ÷ 2.0×106
⇄ V = 5.611 (L)
解答:5.6 L
問4.3Lの容器の中に57℃における16gの酸素がある。圧力を求めなさい。
V=3.0、T=350(K)、n=16/32を理想気体の状態方程式にPV=nRTに代入して
P × 3.0 = 16/32 × 8.314 × 330
⇄ P = 0.5 × 8.314×103 × 330 ÷ 3.0
⇄ P = 457×103 (Pa)
解答:4.6×105 Pa
問5.1Lの容器の中に圧力5.0MPaの窒素が56gある。セルシウス温度(°C)を求めなさい。
P=5.0×106、V=5.0、n=56/28を理想気体の状態方程式にPV=nRTに代入して
5.0×106 × 1.0 = 56/28 × 8.314×103 × T
⇄ P = 5.0×106 × 1.0 ÷ 8.314×103 ÷ 2.0
⇄ V = 300.69 (K)
解答:27℃
演習問題
問1.分子量が44の気体の温度が27℃で、容器内の圧力が7.5MPaであった。この時の容器内の気体の密度d(g/L)を求めなさい。
密度d=質量(g)/体積(L)
理想気体の状態方程式より、![]()
圧力P=7.5×106(Pa)、分子量M=44(g/mol)、R=8.31×103(Pa•L/K•mol)、T=300(K)
上の各々の値を代入して計算すると、![]()
= 132.306
解答:密度d=132 (g/L)
重要:理想気体の状態方程式に関する問題は過去に7回出題されてます。
問2.温度27℃、圧力1.0MPaで気体の密度が1.5kg/m3であるとき、そのモル質量はいくらか求めなさい。
密度![]() より
より![]()
![]() にP=1.0×106Pa、T=8.314×103(Pa•L/K•mol)、T=300(K)、d=1.5(g/m3)を代入して
にP=1.0×106Pa、T=8.314×103(Pa•L/K•mol)、T=300(K)、d=1.5(g/m3)を代入して
M = 1.5 × 8.314×103 ×300 ÷ 1.0×106
= 3.7413
解答:3.74g/mol
重要:理想気体の状態方程式に関する問題は過去に7回出題されてます。
問3.3kmolの窒素が、温度127℃、圧力1.0MPaで容器にある。ある日温度27℃、圧力0.5MPaになっていた。容器から抜けた窒素は何kgであるか。
最初の状態をα、窒素が抜けた状態βとすると理想気体の状態方程式より
PαV=nαRTα・・・①
PβV=nβRTβ・・・②
容器の大きさは一緒なので①÷②より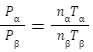
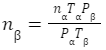 となる。nα=3×103mol、Pα=1.0×106、Tα=400(K)、Pβ=0.5×106Pa、Tβ=300(K)を代入して
となる。nα=3×103mol、Pα=1.0×106、Tα=400(K)、Pβ=0.5×106Pa、Tβ=300(K)を代入して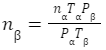 = 3×103 × 0.5×106 × 400 ÷ 1.0×106 ÷ 300
= 3×103 × 0.5×106 × 400 ÷ 1.0×106 ÷ 300
= 2×103mol
容器から抜けた窒素MN2は
MN2 = 28 × (3×103 – 2×103)
= 28×103
解答:28kg
問4.5m3の容器に充填した酸素:窒素のモル比が3:1の混合ガスが25℃で10MPa(絶対圧力)で存在する。この混合ガスが理想気体であるとして、この混合ガスの物質量はいくらか求めなさい。
理想気体の状態方程式よりn = PV/RT
n = 10×106 × 5 ÷ 8.314 ÷ 298
= 20181.048
解答:20.2kmol
問5.分子量56g/molの理想気体が温度27℃、圧力1.2MPaで容器に密閉されている。容器温度一定のまま、中の気体を1.0kg取り出したところ、圧力は0.5MPaとなった。最初に充填されていた気体の質量はいくらか求めなさい。
最初の状態をα、窒素が抜けた状態βとすると理想気体の状態方程式より
PαV=mα/MRT・・・①
PβV=mβ/MRT・・・②
①-②とすると
V(Pα – Pβ) = RT/M (mα – mβ)
V = RT(mα – mβ)/M(Pα – Pβ)
= 8.314×103 × 300 × 1.0×103 ÷ 56 ÷ (1.2-0.5)×106
= 63.6275 (L)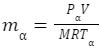
= 1.2 ×106 × 63.6 × 56 ÷ 8.314×103 ÷ 300
= 1.713×103
解答:1.71 kg
問6.理想気体の混合ガスでは、各成分気体の分圧はそれぞれの物質量(mol)に比例するので、それぞれの物質量と全圧がわかれば分圧もわかる。
解答:正しい
解説:分圧とは各成分気体が単独で、混合ガスと同温度、同体積で存在するときに示す圧力のことでドルトンの分圧の法則に従います。
重要:ドルトンの分圧の法則に関する問題は過去に6回出題されてます。
問7.大気圧下で水を加熱するとき、水の飽和蒸気圧が大気圧に等しくなる温度が100℃で、このとき沸騰が始まる。
解答:正しい
解説:液体の蒸気圧は温度の上昇と共に増加する。蒸気圧が外圧(液体の表面にかかる圧力)と等しくなると、液体内部に気泡が発生し沸騰します。
重要:飽和蒸気圧に関する問題は過去に2回出題されてます。
問8.実在気体は、低温条件において理想気体の法則とのずれが大きくなる。
解答:正しい
解説:温度が低くなると、熱運動のエネルギーが小さくなることで、分子間力の影響が相対的に強くなるため、理想気体の状態方程式からずれが生じます。圧力を高くすると体積が小さくなるため、分子の体積の影響が大きくなります。
重要:実在気体に関する問題は過去に2回出題されてます。
問9.空気の平均分子量を28.5とし、比熱容量の比(比熱比)は1.3とする。空気の比熱容量[kJ/(kg・K)]を計算せよ。ただし、気体定数をR=8.3J/(mol-K)とする。
解答:1.3 kJ/(kg・K)
解説:定圧比熱容量cp[J/(kg・K)]は、定圧モル熱容量をCm,p[J/(mol・K)]、モル質量をMとすると![]()
=1.26×103 J/(kg・K) = 1.3 kJ/(kg・K)
重要:比熱容量に関する問題は過去に2回出題されてます。



コメント
問題大体間違ってない..?
コメントありがとうございます。
また、間違いが多く大変失礼致しました。
先ほど、修正いたしました。
演習問4の解答
= 20181.048
解答:2.02kmol
となっていますが、2.02*10^1kmol(20.2kmol)
が正しいと思います。
たびたびの間違い大変申し訳ございません。
おっしゃる通り、2.02*10^1kmol(20.2kmol)が正しい解答のため、先ほど修正致しました。
また、とても参考になるサイトとのコメントいただき大変うれしく思います。
まだまだ、改善点があり、ご迷惑をおかけするかもしれませんが、合格のお役に立てると幸いです。
引き続きよろしくお願いいたします。
非常に迅速な対応を有難うございます。
また、このようなとても参考になるサイトを運営してくださり感謝します。